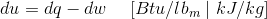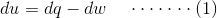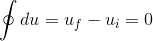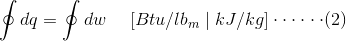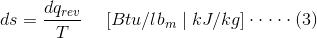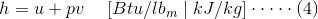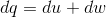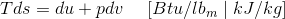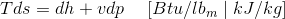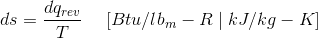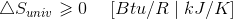目的是发展对以下概念的基本理解:betway必威体育 精装版
- 内部能量和热力学的第一定律
- 系统的循环和任意过程
- 可逆性和不可逆转性
- 熵和焓
- 热力学第二定律
内部能量和热力学的第一定律
当系统内分子的能量与系统的性质相关联时,就称为热力学能(u)。
能量既不被创建也不被摧毁,并基于这个主体系统内部能量(U)每当能量交叉系统边界时都会发生变化。
因此,当热/工作相互作用时,可以表达热力学的第一定律,如下所述。
在上述等式中,U单位质量和Q和W分别是每单位质量的热量和工作。上述等式中采用的符号约定是:
dq > 0(认为是正数)对系统的传热
DQ <0(被认为是负)⇒从系统DW的热传递> 0(被认为是正面的)⇒系统完成的工作
Dw < 0(认为为负)对系统所做的功
系统的循环和任意过程
获得第一条定律的重要形式之一是获得的
我们将上述方程集成在循环过程中。
一个系统据说是在循环过程中,当热/工作恢复到其原始状态后,随机发生在随机变化之后。
要思考的要点是:
- 任何州属性差异的集成都是其限制的差异。
- 最终态和初始态一样,系统的热力学能没有变化。
因此。当
上述等式中内部能量的初始和最终状态由I和F表示。在等式(1)中以上面代替,
等式(2)是由系统完成的所有工作的整体的表示或系统所做的净工作等于所有传热进入系统的整体。工程热力学进一步探索系统和过程的概念。
任意过程的系统
它是热力学第一定律的结果,如果一个系统涉及任意过程,则与等式(1)有关。
在该等式中,Q和W分别是该过程的净热量和网络工作,而UF和UI是内部能量(U)的最终值和初始值。在刚性和孤立的绝热系统中(W = 0,Q = 0),然后其内部能量(U)保持不变。然后来自循环过程的EQ(2)。
可逆性和不可逆转性
当系统的初始状态变为最终状态时,我们说它正在经历一个过程。压强、体积、焓、温度、熵等性质在热力学过程中发生变化。热力学第二定律分类两个头下的过程
- 理想或可逆的过程
- 自然或不可逆转的过程
如果温度(t)和压力(P)变化是在经历-A-过程的系统中的无穷大,则该过程可以称为近平衡状态或接近可逆性。
如果原始状态重新存储在相反的方向上,则据说该过程是可逆的 - 内部内部。
该过程据说是伴随的外部可逆环境,变化也可以反转顺序。
可逆过程是一个在内部和外部可逆的过程。
为了衡量一个真实过程的成功与否,专业人员采用可逆过程作为衡量标准,通过降低损失,使真实过程更接近可逆性,从而提高过程的效率。
不可逆转
当实际过程不能满足可逆性要求时,称为不可逆过程。
在Irfreversibile过程中,系统和周围的初始状态不能从最终状态带回初始状态。系统的熵在不可逆转的过程中急剧增加,并且无法从最终值返回值。
不可逆性的存在是由于压力、成分、温度的变化,主要由传热、固液摩擦、化学反应引起的成分变化。各行各业都在努力降低过程和机制不可逆性的影响。
熵和焓
和热力学能一样,熵和焓都是热力学性质。熵用符号s表示,熵变Δs,单位为kJ/kg-K。熵是一种无序状态。熵是热力学第二定律的主题,它描述了系统和周围环境的熵随宇宙的变化。
熵定义为可逆热力学路径系统中的绝对温度的比率传热。
在哪里,Q.录表示沿着可逆路径的传热。
焓(h)是国家的财产,被定义为
其中,H是特异性焓,U是特定的内能量,V是特定的体积,P是压力。
来自,等式(1)
所以
通过区分EQ(4)并将其替换在上方等式中,然后
以上两个方程都与可逆过程中熵的变化有关,前者是由于热力学能和体积的变化,后者是由于焓和压强的变化。
由于这两个方程中的所有量是状态性质,因此熵也是热力学性质。
热力学第二定律
热力学第二定律以描述宇宙的极限而闻名。2nd法律更多的是处理效率低下,衰退和退化。
我们在日常生活中所做的活动本质上涉及低效和不可逆的过程。
第2条热力学定律可以更方便地表达熵:
熵定义为系统(DS)熵的无限变化是测量的热量的比率,该热量已进入封闭系统(DQREV)和传热发生的点的常见温度(T)。
热力学的第二律规定,“熵变化被认为是非负面”。
或
宇宙能量正逐渐走向无序状态