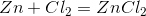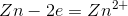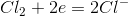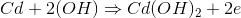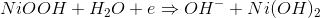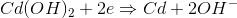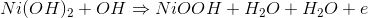在详细讨论这个问题之前。电池充放电,我们先试着理解什么是氧化和还原。因为,电池因氧化和还原反应而放电或充电。
为了理解氧化和还原理论,我们可以直接看一个化学反应的例子。让我们考虑金属锌和氯之间的反应。
在上述反应中,锌首先给出两个电子,成为正离子。
在这里,每个氯原子接受一个电子成为负离子。
现在,这两个带相反电荷的离子结合在一起形成氯化锌(ZnCl)2)
在这个反应中,当锌交出电子时,它被氧化,而氯接受电子,因此它被还原。
当一个原子失去电子时,它的氧化值就会增加。在我们的例子中锌的氧化值从0变成+ 2。随着氧化值的增加,这部分反应称为氧化反应。另一方面,当原子接受电子后,它的负氧化数增加,这意味着原子的氧化数在零参考值下减少。当氧化值降低或降低时,这部分反应称为还原反应。
放电的电池
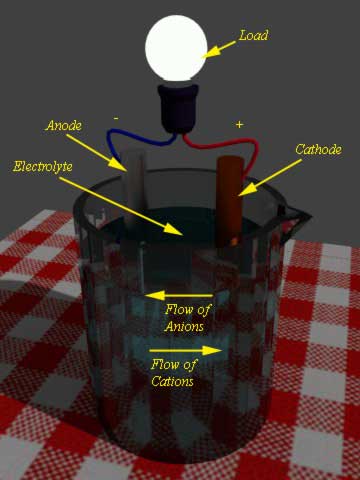
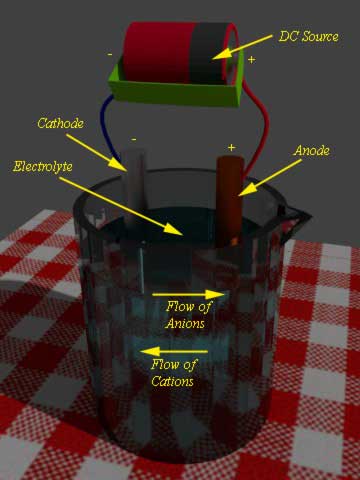
在电池中,有两个电极浸泡在电解液中。当外部负载连接到这两个电极,氧化反应开始发生在一个电极,同时减少发生在其他电极。
在发生氧化的电极上,电子的数量变得过剩。这个电极称为负极或阳极。
另一方面,在放电的电池,另一电极参与还原反应。这个电极称为阴极。在阳极中过剩的电子,现在通过外部负载流向阴极。在阴极中这些电子被接受,这意味着阴极材料参与了还原反应。
现在阳极氧化反应的产物是正离子或阳离子,它们将通过电解液流向阴极,同时,阴极还原反应的产物是负离子或阴离子,它们将通过电解液流向阳极。
让我们以一个实际的例子来说明电池的放电。让我们以镍镉电池为例。这里,镉是阳极或负极。在阳极氧化过程中,金属镉与OH发生反应- - - - - -离子释放两个电子变成氢氧化镉。
这种电池的阴极由氢氧化镍或简单的氧化镍制成。在阴极中,发生还原反应,由于这个还原反应,氢氧化镍通过接受电子而变成氢氧化镍。
充电的电池
在充电的电池,外接直流电源应用于电池。直流电源的负极连接到电池的负极或阳极,电源的正极连接到电池的正极或阴极。
现在,由于外部直流电源,电子将注入阳极。还原反应发生在阳极而不是阴极。实际上,在电池放电的情况下,还原反应发生在阴极。由于这种还原反应,阳极材料将重新获得电子,并返回到之前的状态时,电池未放电。
由于直流电源的正极连接到阴极,该电极的电子将被直流电源的正极吸引。因此,氧化反应发生在阴极和阴极材料恢复其以前的状态(当它没有放电时)。这是电池充电的总体基础。
现在以可充电的镍镉电池为例。在充电的电池,所述充电器直流电源的负极和正极分别连接于所述电池的负极和正极。这里在阳极,由于电子的存在从直流负极,还原发生,由于氢氧化镉再次成为排镉和释放氢氧根离子(OH- - - - - -)到电解质。
在阴极或正极,由于氧化,氢氧化镍变成,氢氧化镍在电解质溶液中释放水。
在充电的电池,二次电池恢复到原来的荷电状态,准备继续放电。